Les polyuréthanes (PUs) ont été découverts dans les années 1930 par Otto Bayer et ont été principalement utilisés pour remplacer les caoutchoucs naturels durant la Seconde Guerre Mondiale 4. Leur production mondiale représente 25,1 millions de tonnes en 2019.1 Les PUs représentent la 6ème classe de polymères 2 derrière le polyéthylène (PE), polypropylène (PP), poly(chlorure de vinyle) (PVC) et poly(téréphtalate d’éthylène) (PET).3 Les PUs sont principalement utilisés dans trois grands domaines: les mousses souples, les mousses rigides et les matériaux non poreux (Figure 1).2 Les mousses souples sont principalement utilisées pour des applications de confort, comme les matelas ou les canapés, les mousses rigides sont utilisées pour l’isolation, dans le domaine du bâtiment notamment et enfin, le dernier domaine regroupe l’ensemble des produits utilisés dans les revêtements, les adhésifs, les peintures et les élastomères par exemple.

Classiquement, les polyuréthanes sont synthétisés par polyaddition de diols (ou de polyols) et de diisocyanates (ou poly-isocyanates) (Figure 1).4 La disponibilité des polyols et des poly-isocyanates permet de générer une très large gamme de matériaux aux propriétés diversifiées.4
Malgré les nombreux avantages que présentent les PUs, leur synthèse peut s’avérer problématique. En effet, le phosgène à l’origine des isocyanates est un gaz mortel et les isocyanates sont classés CMR (Cancérigène, Mutagène et Reprotoxique), donc très toxiques pour l’homme.2 Par ailleurs et comme pour la très grande majorité des polymères, les PUs sont principalement issus de ressources fossiles. La synthèse d’isocyanates biosourcés est possible mais leur dangerosité demeure problématique.5 Dans l’optique de limiter les risques pour les producteurs et les utilisateurs, des alternatives à la synthèse des PUs, par voie « sans isocyanate », ont été étudiées et développées. Elles conduisent à la formation de polymères communément appelées polyuréthanes sans isocyanates (en anglais, Non Isocyanates PolyUrethanes, abrégé NIPUs).
Les voies de synthèse et les propriétés des NIPUs, sont maintenant étudiées depuis de nombreuses années. Plusieurs revues scientifiques ont été publiées et résument ces différentes voies de synthèse.2,4,6–11 Elles peuvent être regroupées selon quatre types de polymérisations: par polycondensation, par polyaddition, par réactions de réarrangement et par ouverture de cycle (Figure 2). De nombreux efforts ont été réalisés pour développer des voies de synthèse des PUs plus vertes et moins dangereuses pour l’homme. Malheureusement, si bon nombre d’entre elles ont éliminé l’usage des isocyanates, elles n’ont pas éliminé l’usage de composés dangereux. L’utilisation de phosgène, de chlorures ou encore d’azotures demeurent nécessaires pour la synthèse des précurseurs des PUs ou pour leur synthèse.

En plus de la limitation des risques chimiques, l’intérêt de trouver des alternatives aux PUs est également de produire des matériaux d’origine renouvelable. Des voies de synthèse prometteuses, étudiées massivement depuis quelques années, mettent en œuvre la polycondensation de bis-carbamate et de polyols ou la polyaddition de polycarbonates cycliques (CCs) et de pluri-amines (Figure 2).2,6 Cette dernière voie de synthèse conduit à l’obtention de poly(hydroxy-uréthane)s (PHUs), qui peuvent être, en grande partie, biosourcés. Ces polymères ont la capacité de répondre aux problématiques évoquées.
Les carbonates sont rarement disponibles naturellement. Une revue de Zhang et al 12 en référence quelques-uns cependant. Il s’agit principalement de monocarbonates issus de plantes (carbonates terpenoïdes), générés par des bactéries ou produits par des champignons. Les polycarbonates cycliques biosourcés ne sont pas plus disponibles naturellement ou synthétiquement, mis à part quelques rares exceptions. Récemment, Wang et al 13 ont cherché à référencer les molécules biosourcés susceptibles de conduire à des carbonates cycliques pour la synthèse des PHUs. Le programme informatique développé par l’équipe de recherche a permis de cibler près de 40 000 molécules CCs potentielles, après une ou deux étapes de synthèse et ce, à partir de 15 molécules biosourcées. De nombreuses voies de synthèse de carbonates cycliques ont de plus été développées et très bien décrites par différentes équipes de recherches, dont les principales sont décrites ci-après.
Une première famille de polycarbonates cycliques peut être synthétisée à partir des acides carboxyliques ou de leur dérivés et le carbonate de glycérol (GC) (Figure 3). Il s’agit des dicarbonates cycliques dits « activés ester ».

Plus précisément, les polycarbonates cycliques activés ester sont obtenus par la dérivatisation d’acides par réaction avec le carbonate de glycérol.14–17 Les acides peuvent également être substitué par leur dérivés, les chlorures d’acyle, pour réagir avec le carbonate de glycérol.18–26 A l’heure actuelle, la synthèse de CCs activés ester a plusieurs limitations afin de produire des polymères entièrement biosourcés. D’une part, le carbonate de glycérol n’est pas entièrement biosourcé et d’autre part, le procédé de dérivatisation des dérivés d’acides nécessite d’être optimisé afin de limiter l’utilisation de solvants ou de réactifs toxiques et ainsi de mieux respecter les principes de la chimie verte.27
La deuxième voie de synthèse des CCs biosourcés largement décrite est la carbonatation des époxydes grâce au CO2 (Figure 4).6,17,28–55 Cette voie de synthèse permet de valoriser le dioxyde de carbone qui est généralement fixé sur les époxydes par un procédé catalysé à haute température et haute pression.

Les époxydes sont générés selon deux voies principales. Les diols-1,2 peuvent être déshydratés pour former les époxydes correspondant34,47,53,56 et les insaturations peuvent également être époxydées. A ce titre, les triglycérides (huiles végétales) et les acides gras sont des substrats d’intérêt57,58 car ils possèdent un nombre variable d’insaturations (entre 1 et 3)15,59–6263. De nombreux types de PHUs peuvent ainsi être synthétisé, aussi bien thermoplastiques que thermodurcissables
Une dernière voie de synthèse permettant l’accès à des carbonates cycliques biosourcés fait appel à la cyclisation de diols (Figure 5), majoritairement 1,2 (pour des dicarbonates cycliques à 5 chaînons) mais aussi 1,3 (pour des dicarbonates cycliques à 6 chaînons)6.

De nombreuses amines sont produites par les organismes vivants et sont présentes dans la nature.64 On peut citer la 1,4-diaminobutane (putrescine) et ses dérivés (musculamine, spermine, thermospermine …) 65 mais également la L-lysine issu du L-aspartate et pouvant conduire à l’obtention de nombreuses diamines telles que le 1,5-diaminopentane (cadavérine) ou l’homoarginine (Figure 6).66 Le chitosane peut également être citer mais sa structure et ses propriétés en font un matériau à part. Il s’agit en effet d’un polysaccharide pluri-amines de la famille des glycosaminoglycanes (Figure 6).
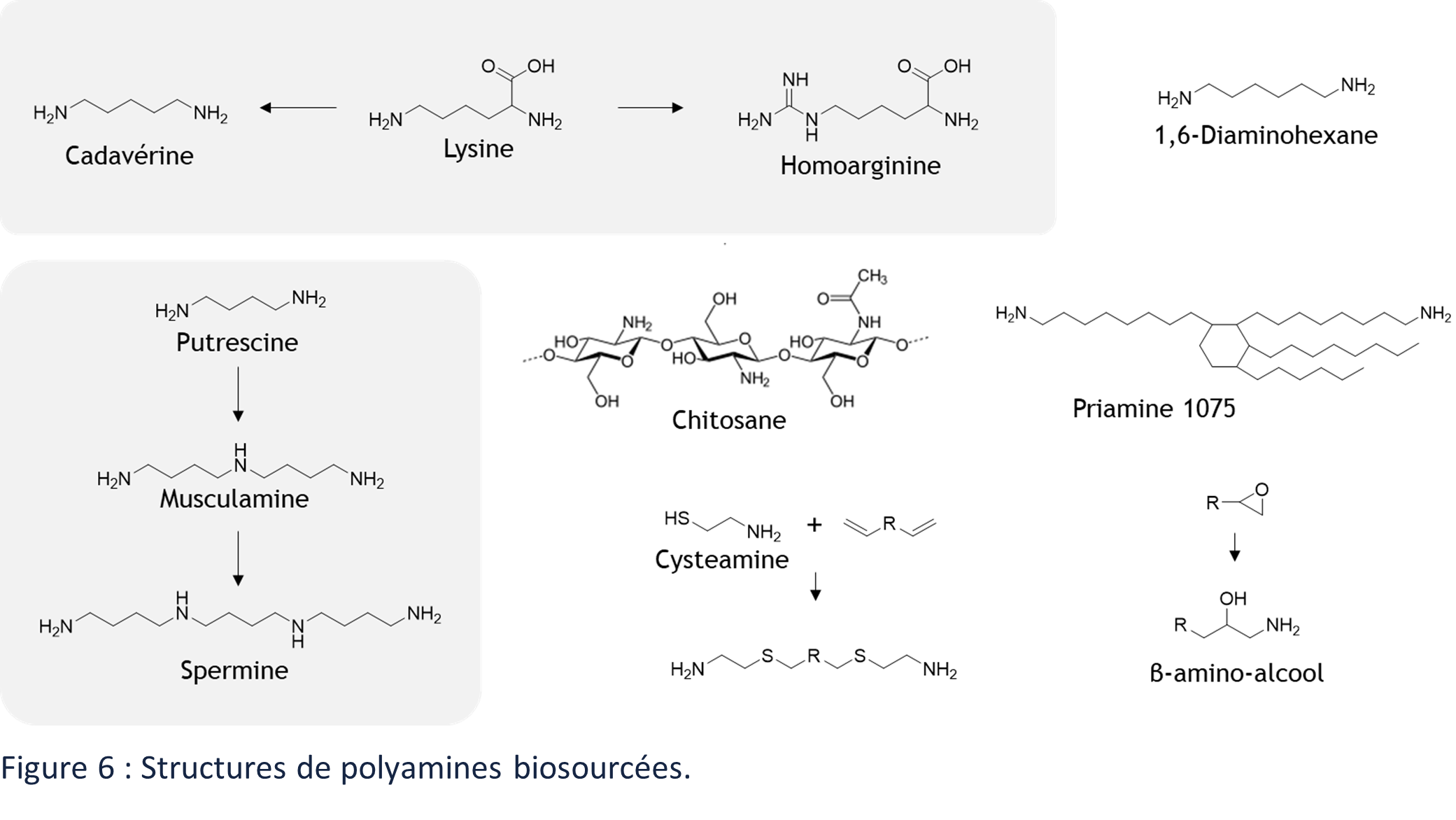
Des revues récentes recensent les différentes voies de synthèse des amines biosourcées.6,67 Les amines peuvent être générées par divers procédés à partir de bioressources mais elles sont le plus souvent issus d’acide carboxylique. L’industrie des polyamides est un important pôle de synthèse de pluri-amines biosourcées68 comme par exemple la 1,4-diaminobutane (BASF), la 1,5-diaminopentane (BAYER, Covestro, Mitsubishi Chemical), la 1,10-decanediamine (Evonik) ou encore la diamine grasse commercialisée sous la marque PriamineTM (CRODA) (Figure 6). Les amines sont par ailleurs largement utilisées pour la synthèse de polymères comme les polyamides.
D’autres voies de synthèses peuvent conduire à l’obtention de pluri-amines particulières. Les époxydes conduisent à l’obtention de β-amino-alcools par fixation de l’ammoniaque sur ceux-ci (Figure 1. 23).69 L’addition « click » de thiols, comme la cysteamine, peut également être utilisé pour fonctionnaliser des dérivés biosourcés comportant des insaturations (Figure 6).70,71
Les recherches concernant les carbonates cycliques ont permis de grandement améliorer leur réactivité vis-à-vis de l’aminolyse et d’atteindre des valeurs proches de celles de leur homologue isocyanate. Cette réactivité peut être améliorer grâce à deux axes principaux : la contrainte des cycles des CCs et l’introduction de groupes électroattracteurs à proximité du cycle des CCs (Figure 7).

Bien que les CCs composés de 5 atomes soient les plus répandus, des CCs à 6 atomes et à 7 atomes ont également été décrits. La réactivité des CCs par rapport à la réaction d’aminolyse est corrélée au nombre d’atome composant les cycles des carbonates et à l’augmentation de la contrainte de cycles. L’énergie d’activation de l’aminolyse des CCs est diminuée par la nombre croissant d’atomes composant leur cycle et la réactivité en présence d’amines est améliorée. 72–74
L’augmentation de la contrainte des cycles, et donc de l’augmentation de leur nombre d’atomes, a pour contrepartie de diminuer la stabilité dans le temps des CCs (Figure 7).75–79 La réactivité des carbonates cycliques, et donc notamment celles des 5CCs, peut cependant être améliorée grâce à la présence d’activateur électrochimique proche du cycle des CCs.
La présence de groupes électroattracteurs d’électrons en position α, β ou γ des carbonates cycliques a pour effet d’augmenter leur réactivité vis-à-vis de la réaction d’aminolyse. Cette activation chimique a été très largement étudiée durant les vingt dernières années afin d’améliorer la réactivité des CCs en présence d’amines.6,77,78,80–82 En résumé, la réactivité des carbonates cycliques est augmenté lorsque l’effet activateur du substituant augmente (Figure 7). Le choix de de la structure chimique des CCs a donc une influence importante sur les cinétiques de polymérisation des PHUs. Choisi avec soin, le CC peut donc conduire à l’obtention de PHUs à basse température (< 80°C) en quelques heures. De même, la cinétique de la réaction d’aminolyse des CCs peut encore être améliorée par le choix de l’amine.
Considérés comme peu dangereux pour l’Homme et l’environnement, les CCs biosourcés présentent une vraie alternative aux poly(isocyanate)s.83,84 La toxicité et la corrosivité des amines est plus problématique, bien que présentes à une certaine teneur chez les organismes vivants.64 En effet, elle dépend principalement de leur structure chimique. Les amines cycliques et aromatiques sont, par exemple, dangereuses voire mortelles tandis que certaines amines linéaires sont peu dangereuses. Sélectionnées et manipulées avec précaution, elles sont globalement moins toxiques que les isocyanates et peuvent être biosourcés.
Les PHUs ont ainsi pour vocation d’être une alternative aux polyuréthanes obtenus par la voie « isocyanates ». Cependant, leur structure chimique hydroxyuréthane diffère de celle des PUs et leurs propriétés sont impactées par cette différence.
La polymérisation des PUs nécessite de prendre quelques précautions car les isocyanates réagissent principalement avec les alcools mais également avec l’eau, les amines ou les acides (Figure 8). La réaction d’aminolyse des CCs présente elle une forte chimiosélectivité. Les polymérisations des PHUs peut ainsi s’effectuer dans des conditions moins contrôlées, avec notamment la présence de trace d’eau, sans engendrer de réaction secondaire
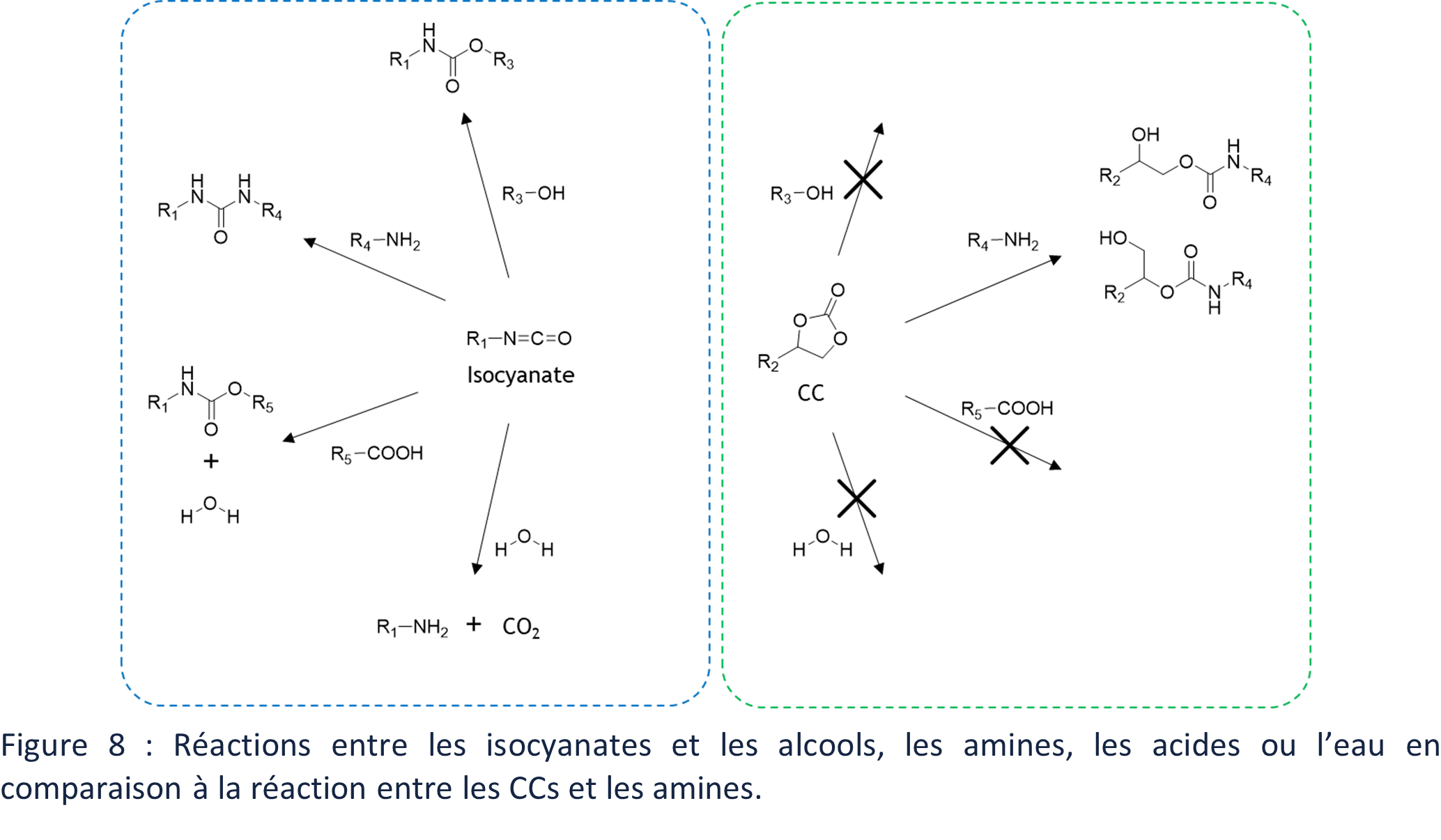
Cette première différence de réactivité entre les monomères utilisés pour la polymérisation des PUs et des PHUs a un impact fort sur les applications de ces familles de polymères. En effet, les réactions secondaires des isocyanates peuvent être des réactions de condensation et génèrent ainsi des gaz, comme par exemple du CO2 en présence d’eau (Figure 8). Ces gaz sont nécessaires et valorisés pour la principale application des PUs, à savoir la formation de mousse. Les PHUs ne peuvent eux pas être utilisé directement pour cette application.
La polymérisation des PHUs se démarque un peu plus de celle des PUs car il s’agit d’une polymérisation par ouverture de cycles des CCs en présence d’amine. Cette aminolyse des CCs génèrent des groupes hydroxyle primaire (OH)I (en position α de l’uréthane) ou secondaire (OH)II (en position β de l’uréthane) (Figure 9)
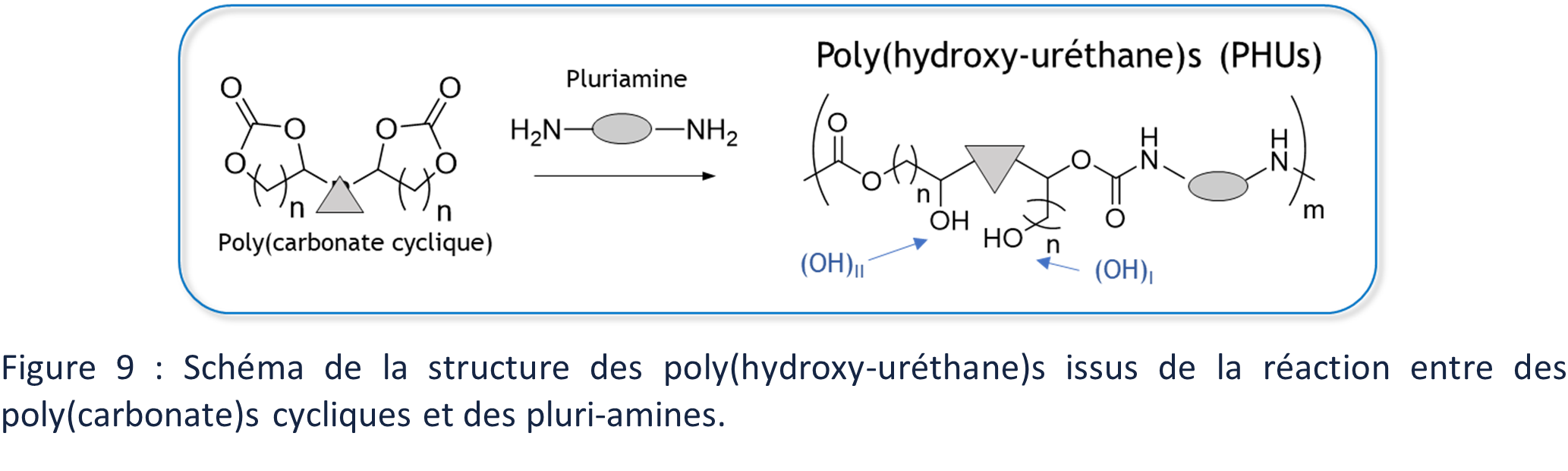
Bien que les PHUS soient rarement comparés directement à leur homologue PUs car il n’est pas aisé de trouver des couples de monomères CCs/amines similaires aux couples polyols/poly(isocyanate)s, la présence de groupes hydroxyle le long du squelette a démontré avoir un impact sur les propriétés des PHUs par rapport à celles des PUs. Ainsi, les propriétés thermiques, comme les températures de transition vitreuse et de dégradation thermique, des PHU sont plus élevés que celles de PUs de structure comparable.51,85 La solubilité du PHU est parallèlement réduite dans les solvants usuels tels que le dichlorométhane ou le chloroforme, par rapport au PU. Ces propriétés sont expliquées par la capacité des (OH)s à également interagir par liaisons hydrogène (Figure 10). Les PHUs sont également parfois présentés comme possédant une meilleure résistance chimique, notamment à l’hydrolyse, grâce à la protection du carbonyle de la liaison uréthane par les groupes hydroxyle. 8,86,87

L’ensemble de ces propriétés induites par les (OH)s font des PHUs des polymères particulièrement adaptés aux applications de type revêtements ou adhésifs, comme il a très bien été décrit dans deux revues récentes, une seconde de Gomez-Lopez et al88 et une de Khatoon et al89. Les PUs exhibent déjà ainsi d’excellentes propriétés de résistance à l’abrasion et d’adhésivité grâce notamment à la formation de micro agrégats induits par les fortes interactions électrostatiques de type liaisons hydrogène entre les liaisons uréthanes.90 Mais les PHUs, également composés de liaisons uréthanes, sont d’autant plus adaptés à des utilisations pour les adhésifs et les revêtements grâce aux (OH)s. Leur propriétés d’adhésion aux substrats sont améliorés par rapport à leur homologue PUs aux propriétés similaires.85,89,91
Les domaines d’applications des PHUs sont variés. La présence de groupes hydroxyle au cœur des chaines polymères permet aux PHUs d’avoir de nombreuses interactions électrostatiques, notamment de type liaisons hydrogène. Cela en fait des matériaux particulièrement adaptés pour des applications nécessitant des affinités substrat/polymère fortes comme les revêtements ou les adhésifs. Les PHUs ont également la propriété d’être issus de bioressources, comme il a été vu, ce qui en font des matériaux d’avenir aux propriétés complémentaires des PUs.
1. Fernandez L. Global polyurethane market volume 2015-2021. Statista. Published 2021. https://www.statista.com/statistics/720341/global-polyurethane-market-size-forecast/
2. Cornille A, Auvergne R, Figovsky O, Boutevin B, Caillol S. A perspective approach to sustainable routes for non-isocyanate polyurethanes. Eur Polym J. 2017;87:535-552. doi:10.1016/j.eurpolymj.2016.11.027
3. Hicks D. A review of the global PU industry in 2016 and outlook for 2017. 2018;(February 2017).
4. Akindoyo JO, Beg MDH, Ghazali S, Islam MR, Jeyaratnam N, Yuvaraj AR. Polyurethane types, synthesis and applications-a review. RSC Adv. 2016;6(115):114453-114482. doi:10.1039/c6ra14525f
5. Kreye O, Mutlu H, Meier MAR. Sustainable routes to polyurethane precursors. Green Chem. 2013;15:1431-1455. doi:10.1039/c3gc40440d
6. Maisonneuve L, Lamarzelle O, Rix E, Grau E, Cramail H. Isocyanate-Free Routes to Polyurethanes and Poly(hydroxy Urethane)s. Chem Rev. 2015;115(22):12407-12439. doi:10.1021/acs.chemrev.5b00355
7. Delebecq E, Pascault J-P, Boutevin B, Ganachaud F. On the Versatility of Urethane/Urea Bonds: Reversibility, Blocked Isocyanate, and Non-isocyanate Polyurethane. Chem Rev. 2013;113(1):80-118. doi:10.1021/cr300195n
8. Kathalewar MS, Joshi PB, Sabnis AS, Malshe VC. Non-isocyanate polyurethanes: From chemistry to applications. RSC Adv. 2013;3:4110-4129. doi:10.1039/c2ra21938g
9. Rokicki G, Parzuchowski PG, Mazurek M. Non-isocyanate polyurethanes: Synthesis, properties, and applications. Polym Adv Technol. 2015;26(7):707-761. doi:10.1002/pat.3522
10. Figovsjy Oleg; Shapolavov, Leonid; Leykin Alexander; Birukova, Olga; Potashnikova R. Recent advances in the development of non-isocyanate polyurethanes based on cyclic carbonates. PU Mag. 2013;10(4):2-9. doi:10.1109/PPC.2013.6627453
11. Hannes B, Maria F, Moritz B, Rolf M. Isocyanate- and Phosgene-Free Routes to Polyfunctional Cyclic Carbonates and Green Polyurethanes by Fixation of Carbon Dioxide. Macromol Rapid Commun. 2014;35(14):1238-1254. doi:10.1002/marc.201400209
12. Zhang H, Liu HB, Yue JM. Organic carbonates from natural sources. Chem Rev. 2014;114(1):883-898. doi:10.1021/cr300430e
13. Wang G, Lopez L, Coile M, Chen Y, Torkelson JM, Broadbelt LJ. Identification of known and novel monomers for poly(hydroxyurethanes) from biobased materials. Ind Eng Chem Res. 2021;60(18):6814-6825. doi:10.1021/acs.iecr.0c06351
14. Helou M, Carpentier JF, Guillaume SM. Poly(carbonate-urethane): An isocyanate-free procedure from α,ω-di(cyclic carbonate) telechelic poly(trimethylene carbonate)s. Green Chem. 2011;13:266-271. doi:10.1039/c0gc00686f
15. Mokhtari C, Malek F, Manseri A, Caillol S, Negrell C. Reactive jojoba and castor oils-based cyclic carbonates for biobased polyhydroxyurethanes. Eur Polym J. 2019;113:18-28. doi:10.1016/j.eurpolymj.2019.01.039
16. Duval C, Kébir N, Jauseau R, Burel F. Organocatalytic synthesis of novel renewable non-isocyanate polyhydroxyurethanes. J Polym Sci Part A Polym Chem. 2016;54(6):758-764. doi:10.1002/pola.27908
17. Benyahya S, Habas JP, Auvergne R, Lapinte V, Caillol S. Structure-property relationships in polyhydroxyurethanes produced from terephthaloyl dicyclocarbonate with various polyamines. Polym Int. 2012;61(11):1666-1674. doi:10.1002/pi.4257
18. Carré C, Bonnet L, Avérous L. Original biobased nonisocyanate polyurethanes: Solvent- and catalyst-free synthesis, thermal properties and rheological behaviour. RSC Adv. 2014;4:54018-54025. doi:10.1039/c4ra09794g
19. Carré C, Bonnet L, Avérous L. Solvent- and catalyst-free synthesis of fully biobased nonisocyanate polyurethanes with different macromolecular architectures. RSC Adv. 2015;5(121):100390-100400. doi:10.1039/c5ra17638g
20. Magliozzi F, Chollet G, Grau E, Cramail H. Benefit of the Reactive Extrusion in the Course of Polyhydroxyurethanes Synthesis by Aminolysis of Cyclic Carbonates. ACS Sustain Chem Eng. 2019;7:17282-17292. doi:10.1021/acssuschemeng.9b04098
21. Cornille A, Blain M, Auvergne R, Andrioletti B, Boutevin B, Caillol S. A study of cyclic carbonate aminolysis at room temperature: Effect of cyclic carbonate structures and solvents on polyhydroxyurethane synthesis. Polym Chem. 2017;8(3):592-604. doi:10.1039/c6py01854h
22. Bizet B, Grau E, Cramail H, Asua JM. Volatile Organic Compound-Free Synthesis of Waterborne Poly(hydroxy urethane)–(Meth)acrylic Hybrids by Miniemulsion Polymerization. ACS Appl Polym Mater. 2020;2(9):4016-4025. doi:10.1021/acsapm.0c00657
23. Bizet B, Grau E, Cramail H, Asua JM. Crosslinked isocyanate-free poly(hydroxy urethane)s – Poly(butyl methacrylate) hybrid latexes. Eur Polym J. 2021;146(December 2020). doi:10.1016/j.eurpolymj.2020.110254
24. Quérette T, Bordes C, Sintes-Zydowicz N. Non-isocyanate polyurethane nanoprecipitation: Toward an optimized preparation of poly(hydroxy)urethane nanoparticles. Colloids Surfaces A. 2020;589:124371. doi:10.1016/j.colsurfa.2019.124371
25. Jaratrotkamjorn R, Nourry A, Pasetto P, et al. Synthesis and characterization of elastomeric, biobased, nonisocyanate polyurethane from natural rubber. J Appl Polym Sci. Published online 2017:1-12. doi:10.1002/app.45427
26. Carré C, Zoccheddu H, Delalande S, Pichon P, Avérous L. Synthesis and characterization of advanced biobased thermoplastic nonisocyanate polyurethanes, with controlled aromatic-aliphatic architectures. Eur Polym J. 2016;84:759-769. doi:10.1016/j.eurpolymj.2016.05.030
27. Anastas P, Eghbali N. Green Chemistry: Principles and Practice. Chem Soc Rev. 2010;39(1):301-312. doi:10.1039/b918763b
28. Ménard R, Caillol S, Allais F. Chemo-enzymatic synthesis and characterization of renewable thermoplastic and thermoset isocyanate-free poly(hydroxy)urethanes from ferulic acid derivatives. ACS Sustain Chem Eng. 2017;5(2):1446-1456. doi:10.1021/acssuschemeng.6b02022
29. Schimpf V, Max JB, Stolz B, Heck B, Mülhaupt R. Semicrystalline Non-Isocyanate Polyhydroxyurethanes as Thermoplastics and Thermoplastic Elastomers and Their Use in 3D Printing by Fused Filament Fabrication. Macromolecules. 2019;52(1):320-331. doi:10.1021/acs.macromol.8b01908
30. Wulf C, Reckers M, Perechodjuk A, Werner T. Catalytic Systems for the Synthesis of Biscarbonates and Their Impact on the Sequential Preparation of Non-Isocyanate Polyurethanes. ACS Sustain Chem Eng. 2020;8:1651-1658. doi:10.1021/acssuschemeng.9b06662
31. Doley S, Dolui SK. Solvent and catalyst-free synthesis of sun fl ower oil based polyurethane through non-isocyanate route and its coatings properties. Eur Polym J. 2018;102:161-168.
32. Kihara N, Endo T. Synthesis and Properties of Poly ( hydroxyurethane ) s. :2765-2773.
33. Ke J, Li X, Jiang S, et al. Promising approaches to improve the performances of hybrid non-isocyanate polyurethane. Polym Int. 2019;68(4):651-660. doi:10.1002/pi.5746
34. Nanclares J, Petrovic ZS, Javni I, Ionescu M, Jaramillo F. Segmented polyurethane elastomers by nonisocyanate route. J Appl Polym Sci. Published online 2015:7-14. doi:10.1002/app.42492
35. Gennen S, Grignard B, Thomassin JM, et al. Polyhydroxyurethane hydrogels: Synthesis and characterizations. Eur Polym J. 2016;84:849-862. doi:10.1016/j.eurpolymj.2016.07.013
36. Tomita H, Sanda F, Endo T. Structural analysis of polyhydroxyurethane obtained by polyaddition of bifunctional five-membered cyclic carbonate and diamine based on the model reaction. J Polym Sci Part A Polym Chem. 2001;39:851-859. doi:10.1002/1099-0518(20010315)39:6<851::AID-POLA1058>3.0.CO;2-3
37. Steblyanko A, Choi W, Sanda F, Endo T. Addition of Five-Membered Cyclic Carbonate with Amine and Its Application to Polymer Synthesis. J Polym Sci Part A Polym Chem. 2000;38:2375-2380.
38. Sukumaran Nair A, Cherian S, Balachandran N, Panicker UG, Kalamblayil Sankaranarayanan SK. Hybrid Poly(hydroxy urethane)s: Folded-Sheet Morphology and Thermoreversible Adhesion. ACS Omega. 2019;4(8):13042-13051. doi:10.1021/acsomega.9b00789
39. Ochiai B, Inoue S, Endo T. One-pot non-isocyanate synthesis of polyurethanes from bisepoxide, carbon dioxide, and diamine. J Polym Sci Part A Polym Chem. 2005;43(24):6613-6618. doi:10.1002/pola.21103
40. Lombardo VM, Dhulst EA, Leitsch EK, et al. Cooperative catalysis of cyclic carbonate ring opening: Application towards non-isocyanate polyurethane materials. European J Org Chem. Published online 2015:2791-2795. doi:10.1002/ejoc.201500313
41. Beniah G, Liu K, Heath WH, Miller MD, Scheidt KA, Torkelson JM. Novel thermoplastic polyhydroxyurethane elastomers as effective damping materials over broad temperature ranges. Eur Polym J. 2016;84:770-783. doi:10.1016/j.eurpolymj.2016.05.031
42. Beniah G, Chen X, Uno BE, et al. Combined Effects of Carbonate and Soft-Segment Molecular Structures on the Nanophase Separation and Properties of Segmented Polyhydroxyurethane. Macromolecules. 2017;50(8):3193-3203. doi:10.1021/acs.macromol.6b02513
43. Leitsch EK, Beniah G, Liu K, et al. Nonisocyanate Thermoplastic Polyhydroxyurethane Elastomers via Cyclic Carbonate Aminolysis: Critical Role of Hydroxyl Groups in Controlling Nanophase Separation. ACS Macro Lett. 2016;5:424-429. doi:10.1021/acsmacrolett.6b00102
44. Beniah G, Fortman DJ, Heath WH, Dichtel WR, Torkelson JM. Non-Isocyanate Polyurethane Thermoplastic Elastomer: Amide-Based Chain Extender Yields Enhanced Nanophase Separation and Properties in Polyhydroxyurethane. Macromolecules. 2017;50:4425-4434. doi:10.1021/acs.macromol.7b00765
45. Beniah G, Uno BE, Lan T, et al. Tuning nanophase separation behavior in segmented polyhydroxyurethane via judicious choice of soft segment. Polymer (Guildf). 2017;110:218-227. doi:10.1016/j.polymer.2017.01.017
46. Beniah G, Heath WH, Torkelson JM. Functionalization of hydroxyl groups in segmented polyhydroxyurethane eliminates nanophase separation. J Polym Sci Part A Polym Chem. 2017;55:3347-3351. doi:10.1002/pola.28722
47. Ma Z, Li C, Fan H, Wan J, Luo Y, Li BG. Polyhydroxyurethanes (PHUs) Derived from Diphenolic Acid and Carbon Dioxide and Their Application in Solvent- and Water-Borne PHU Coatings. Ind Eng Chem Res. 2017;56:14089-14100. doi:10.1021/acs.iecr.7b04029
48. Maisonneuve L, More AS, Foltran S, et al. Novel green fatty acid-based bis-cyclic carbonates for the synthesis of isocyanate-free poly(hydroxyurethane amide)s. RSC Adv. 2014;4:25795-25803. doi:10.1039/c4ra03675a
49. Arunachalam R, Chinnaraja E, Subramanian S, Suresh E, Subramanian PS. Catalytic Conversion of Carbon Dioxide Using Binuclear Double-Stranded Helicates: Cyclic Carbonate from Epoxides and Diol. ACS Omega. 2020;5(25):14890-14899. doi:10.1021/acsomega.9b04241
50. North M, Pasquale R. Mechanism of cyclic carbonate synthesis from epoxides and CO2. Angew Chemie – Int Ed. 2009;48(16):2946-2948. doi:10.1002/anie.200805451
51. Kihara N, Endo T. Synthesis and Properties of Poly (hydroxyurethane)s. J Polym Sci Part A Polym Chem. 1993;31:2765-2773.
52. Steblyanko A, Choi W, Sanda F, Endo T. Addition of five-membered cyclic carbonate with amine and its application to polymer synthesis. J Polym Sci Part A Polym Chem. 2000;38(13):2375-2380. doi:10.1002/1099-0518(20000701)38:13<2375::AID-POLA100>3.0.CO;2-U
53. BROCAS A-L, CENDEJAS G, CAILLOL S, DEFFIEUX A, CARLOTTI S. Controlled Synthesis of Polyepichlorohydrin with Pendant Cyclic Carbonate Functions for Isocyanate-Free Polyurethane Networks. J Polym Sci Part A Polym Chem. 2011;49:2677–2684. doi:10.1002/pola
54. Guillame SM, Khalil H, Misra M. Green and sustainable polyurethanes for advanced applications. J Appl Polym Sci. 2017;134(45). doi:10.1002/app.45646
55. Zareanshahraki F, Asemani HR, Skuza J, Mannari V. Synthesis of non-isocyanate polyurethanes and their application in radiation-curable aerospace coatings. Prog Org Coatings. 2020;138(September 2019):105394. doi:10.1016/j.porgcoat.2019.105394
56. Auvergne R, Caillol S, David G, Boutevin B, Pascault JP. Biobased thermosetting epoxy: Present and future. Chem Rev. 2014;114(2):1082-1115. doi:10.1021/cr3001274
57. Lee DS, Noh BS, Bae SY, Kim K. Characterization of fatty acids composition in vegetable oils by gas chromatography and chemometrics. Anal Chim Acta. 1998;358(2):163-175. doi:10.1016/S0003-2670(97)00574-6
58. Kim J, Kim DN, Lee SH, Yoo SH, Lee S. Correlation of fatty acid composition of vegetable oils with rheological behaviour and oil uptake. Food Chem. 2010;118(2):398-402. doi:10.1016/j.foodchem.2009.05.011
59. Yu AZ, Setien RA, Sahouani JM, Docken J, Webster DC. Catalyzed non-isocyanate polyurethane (NIPU) coatings from bio-based poly(cyclic carbonates). J Coatings Technol Res. 2018;16(1):41-57. doi:10.1007/s11998-018-0135-7
60. Poussard L, Mariage J, Grignard B, et al. Non-Isocyanate Polyurethanes from Carbonated Soybean Oil Using Monomeric or Oligomeric Diamines to Achieve Thermosets or Thermoplastics. Macromolecules. 2016;49(6):2162-2171. doi:10.1021/acs.macromol.5b02467
61. Tan SG, Chow WS. Biobased epoxidized vegetable oils and its greener epoxy blends: A review. Polym – Plast Technol Eng. 2010;49(15):1581-1590. doi:10.1080/03602559.2010.512338
62. Laprise CM, Hawboldt KA, Kerton FM, Kozak CM. Synthesis of a Renewable, Waste-Derived Nonisocyanate Polyurethane from Fish Processing Discards and Cashew Nutshell-Derived Amines. Macromol Rapid Commun. 2021;42(3):1-5. doi:10.1002/marc.202000339
63. Johns A, Gibbons L, Smith M, Edwards K, Quirino RL. Plant Oil-based Polyhydroxyurethanes. In: Madbouly SA, Zhang C, Kessler MR, eds. Bio-Based Plant Oil Polymers and Composites. Elsevier; 2016:55-70.
64. Pegg AE. Toxicity of polyamines and their metabolic products. Chem Res Toxicol. 2013;26(12):1782-1800. doi:10.1021/tx400316s
65. Bitrián M, Zarza X, Altabella T, Tiburcio AF, Alcázar R. Polyamines under abiotic stress: Metabolic crossroads and hormonal crosstalks in plants. Metabolites. 2012;2(3):516-528. doi:10.3390/metabo2030516
66. Jancewicz AL, Gibbs NM, Masson PH. Cadaverine’s functional role in plant development and environmental response. Front Plant Sci. 2016;7(June):1-8. doi:10.3389/fpls.2016.00870
67. Froidevaux V, Negrell C, Caillol S, Pascault JP, Boutevin B. Biobased Amines: From Synthesis to Polymers; Present and Future. Chem Rev. 2016;116(22):14181-14224. doi:10.1021/acs.chemrev.6b00486
68. De Jong E, Stichnothe H, Bell G, Jorgensen H. Bio-Based Chemicals: A 2020 Update.; 2020. https://task42.ieabioenergy.com/wp-content/uploads/sites/10/2020/02/Bio-based-chemicals-a-2020-update-final-200213.pdf
69. Blattmann H, Mülhaupt R. Multifunctional β-amino alcohols as bio-based amine curing agents for the isocyanate- and phosgene-free synthesis of 100% bio-based polyhydroxyurethane thermosets. Green Chem. 2016;18(8):2406-2415. doi:10.1039/c5gc02563j
70. Fache M, Darroman E, Besse V, Auvergne R, Caillol S, Boutevin B. Vanillin, a promising biobased building-block for monomer synthesis. Green Chem. 2014;16(4):1987-1998. doi:10.1039/c3gc42613k
71. Darroman E, Auvergne R, Boutevin B, Caillol S, Equipe IAM. New aromatic amine based on cardanol giving new biobased epoxy networks with cardanol†. Eur J Lipid Sci Technol. Published online 2014.
72. Yuen A, Bossion A, Bengoa EG-, et al. Room temperature synthesis of non‐isocyanate polyurethanes (NIPUs) using highly reactive N‐substituted 8‐membered cyclic carbonates. Polym Chem. 2016;7(11):2105-2111.
73. Tomita H, Sanda F, Endo T. Polyaddition of bis(seven-membered cyclic carbonate) with diamines: A novel and efficient synthetic method for polyhydroxyurethanes. J Polym Sci Part A Polym Chem. 2001;39(23):4091-4100. doi:10.1002/pola.10058
74. Tomita H, Sanda F, Endo T. Polyaddition Behavior of bis ( Five- and Six-Membered Cyclic Carbonate ) s with Diamine. Published online 2000:860-867.
75. He Y, Keul H, Möller M. Synthesis, characterization, and application of a bifunctional coupler containing a five- and a six-membered ring carbonate. React Funct Polym. 2011;71(2):175-186. doi:10.1016/j.reactfunctpolym.2010.11.031
76. Besse V, Foyer G, Auvergne R, Caillol S, Boutevin B. Access to nonisocyanate poly(thio)urethanes: A comparative study. J Polym Sci Part A Polym Chem. 2013;51:3284-3296. doi:10.1002/pola.26722
77. Lamarzelle O, Durand PL, Wirotius AL, Chollet G, Grau E, Cramail H. Activated lipidic cyclic carbonates for non-isocyanate polyurethane synthesis. Polym Chem. 2016;7(7):1439-1451. doi:10.1039/c5py01964h
78. Cornille A, Blain M, Auvergne R, Andrioletti B, Boutevin B, Caillol S. A study of cyclic carbonate aminolysis at room temperature: Effect of cyclic carbonate structures and solvents on polyhydroxyurethane synthesis. Polym Chem. Published online 2017:592-604. doi:10.1039/c6py01854h
79. Maisonneuve L, Wirotius AL, Alfos C, Grau E, Cramail H. Fatty acid-based (bis) 6-membered cyclic carbonates as efficient isocyanate free poly(hydroxyurethane) precursors. Polym Chem. 2014;5:6142-6147. doi:10.1039/c4py00922c
80. Tomita H, Sanda F, Endo T. Model reaction for the synthesis of polyhydroxyurethanes from cyclic carbonates with amines: Substituent effect on the reactivity and selectivity of ring-opening direction in the reaction of five-membered cyclic carbonates with amine. J Polym Sci Part A Polym Chem. 2001;39(21):3678-3685. doi:10.1002/pola.10009
81. Garipov RM, Sysoev VA, Mikheev V V., et al. Reactivity of Cyclocarbonate Groups in Modified Epoxy–Amine Compositions. Dokl Phys Chem. 2003;393:289-292. doi:10.1023/B
82. Goldstein BN, Goryunov AN, Gotlib YY, et al. Investigation of cooperative kinetics on reactions of functional groups on polymer chains. J Polym Sci Part A-2 Polym Phys. 1971;9(5):769-777. doi:10.1002/pol.1971.160090501
83. Schäffner B, Schäffner F, Verevkin SP, Börner A. Organic carbonates as solvents in synthesis and catalysis. Chem Rev. 2010;110(8):4554-4581. doi:10.1021/cr900393d
84. Lopes EJC, Ribeiro APC, Martins LMDRS. New Trends in the Conversion of CO2 to Cyclic Carbonates. Catalysts. 2020;10(479). doi:10.1016/b978-0-12-433804-3.50012-3
85. Leitsch EK, Heath WH, Torkelson JM. Polyurethane/polyhydroxyurethane hybrid polymers and their applications as adhesive bonding agents. Int J Adhes Adhes. 2016;64:1-8. doi:10.1016/j.ijadhadh.2015.09.001
86. Datir PR. A novel cyclocarbonate based technology for isocyanate free polyurethane. Published online 2007.
87. Pouladi J, Mirabedini SM, Eivaz Mohammadloo H, Rad NG. Synthesis of novel plant oil-based isocyanate-free urethane coatings and study of their anti-corrosion properties. Eur Polym J. 2021;153(April):110502. doi:10.1016/j.eurpolymj.2021.110502
88. Gomez-Lopez A, Panchireddy S, Grignard B, et al. Poly(hydroxyurethane) Adhesives and Coatings: State-of-the-Art and Future Directions. ACS Sustain Chem Eng. 2021;9(29):9541-9562. doi:10.1021/acssuschemeng.1c02558
89. Khatoon H, Iqbal S, Irfan M, Darda A, Rawat NK. A review on the production, properties and applications of non-isocyanate polyurethane: A greener perspective. Prog Org Coatings. 2021;154(February):106124. doi:10.1016/j.porgcoat.2020.106124
90. Szycher M. Polyurethane Adhesives. In: Szycher’s Handbook of Polyurethanes. Szycher, M. Taylor and Francis Group: Boca Raton; 2013:393−416.
91. Llevot A, Meier M. Perspective: green polyurethane synthesis for coating applications. Polym Int. 2019;68(5):826-831. doi:10.1002/pi.5655

